 2021.03.25
2021.03.25  1511次
1511次
导言
今天小编分享一篇2020年4月3日发表于Nature Communications的文章——An oncopeptide regulates m6A recognition by the m6A reader IGF2BP1 and tumorigenesis. N6-甲基腺苷(m6A)是真核RNA中最普遍的修饰。m6A的生物学重要性取决于控制 mRNA 命运和功能的m6A阅读蛋白。然而,m6A阅读蛋白的其他调控亚基是否参与RNA的m6A识别尚待探讨。在这里,研究者发现长链非编码RNA(LncRNA)LINC00266-1编码71个氨基酸肽。该肽主要与包括m6A阅读蛋白IGF2BP1 在内的RNA 结合蛋白相互作用,因此被称为“RNA结合调节肽”(RBRP)。RBRP与IGF2BP1结合并增强IGF2BP1对RNA(例如c-Myc mRNA)的m6A识别,从而增加mRNA的稳定性和c-Myc的表达,促进肿瘤发生。高表达RBRP的癌症患者预后较差,因此由LINC00266-1编码的癌肽RBRP 是m6A阅读蛋白的调节亚基,并通过m6A阅读蛋白增强对靶RNA的m6A识别,从而发挥致癌作用。
前期研究
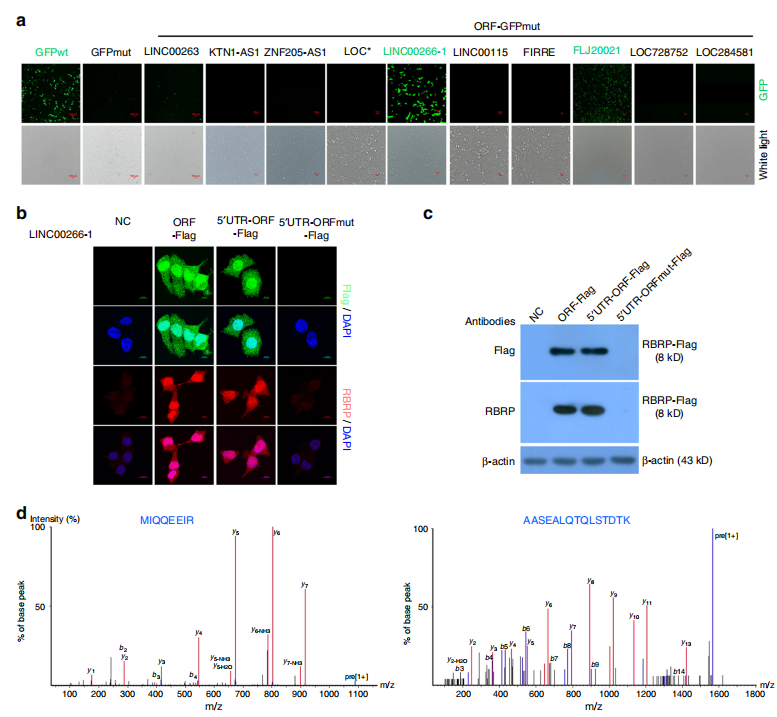
目前研究发现具有编码功能的LncRNA都必须与核糖体结合,所以作者对SW480和SW620细胞的核糖体结合的LncRNA进行测序,得到384个有差异表达的LncRNA,再通过软件分析找出55个具有编码潜力的LncRNA。进一步筛选了10个LncRNA,分别与起始密码子突变的GFP(GFPmut)的N末端融合,将构建体转染到HeLa细胞中检测GFP荧光。结果发现只有LINC00266-1和FLJ20021的ORF能够被翻译(图a)。通过对LINC00266-1的分析,研究者发现一个213个核苷酸的短ORF,参与编码71-aa肽,将其命名为RBRP。通过序列比较,表明RBRP是一个未被鉴定过的肽。在 LINC00266-1 ORF-Flag(ORF)和5'UTR-ORF-Flag(5'U)转染的细胞中观察到RBRP-Flag融合肽的大量表达,而起始密码子ATG(5' UTR-ORFmut-Flag,MT)取消了LINC00266-1中预测的ORF的翻译(图b,c)。进一步将LINC00266-1 ORF-GFPmut融合构建体转染到HEK293T细胞中,使用GFP抗体免疫沉淀RBRP-GFP融合肽,质谱鉴定RBRP肽中两个独特的肽片段(图d)。
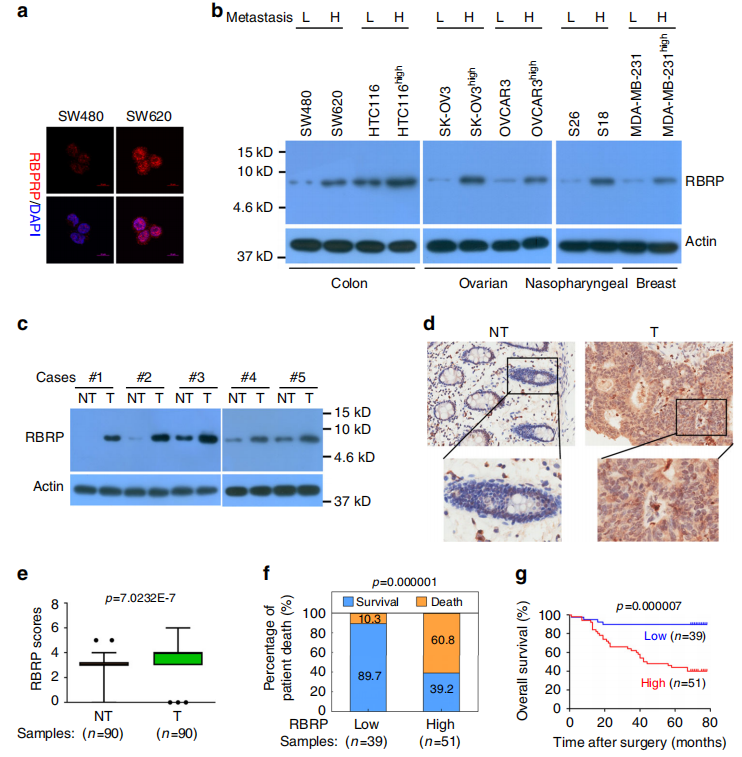
接下来,研究者鉴定具有编码潜力的LncRNA。用抗RBRP抗体检测细胞RBRP肽验证细胞和组织中天然内源性RBRP肽的存在和表达。在结直肠癌、乳腺癌、卵巢癌和鼻咽癌细胞中验证了天然内源性RBRP肽(图a,b)。此外,RBRP肽被证实是天然内源性的在五对配对的新鲜原发性结直肠癌组织及其相应的邻近非肿瘤性结直肠组织中产生(图c)。最后,利用MS分析鉴定了天然内源性RBRP肽中的三个独特肽片段进一步表明天然内源性RBRP肽存在于癌症组织中。通过Kaplan-Meier生存分析显示,RBRP水平较高的结直肠癌患者的癌症相关死亡风险高于RBRP水平较低的患者,并且高RBRP水平与结直肠癌患者不良预后之间存在显著的相关性(图f-g)。前期的研究结果表明,RBRP可能是一个潜在的致癌基因。
功能验证
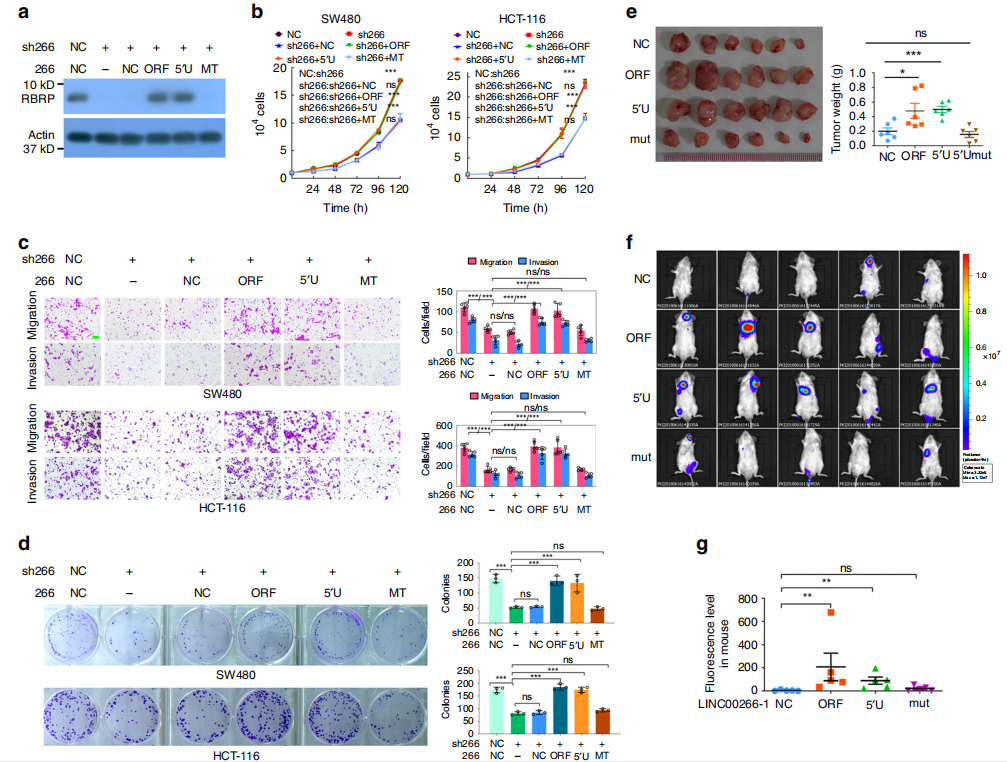
为了研究LINC00266-1有没有直接致癌作用,研究者通过shRNA直接把其敲低,通过肿瘤细胞增殖、集落形成、迁移和侵袭检测发现:敲除LINC00266-1后,细胞生长、集落形成、迁移和侵袭显著减少,而添加ORF表达后这些改变恢复到对照水平,但Mut组没有恢复。这表明RBRP 肽可以促进肿瘤发生,但LINC00266-1本身并不促进(图a-d)。细胞功能实验做完后,研究者在动物体内实验进一步验证,结果与细胞实验相符,即恢复组促进癌细胞增长,而Mut组没有变化(图e-g)。总的来讲,研究者发现由LncRNA LINC00266-1编码产生的RBRP肽有致癌作用(不是LINC00266-1本身),并且RBRP在体外和体内均能促进肿瘤的发生和转移。
深入挖掘
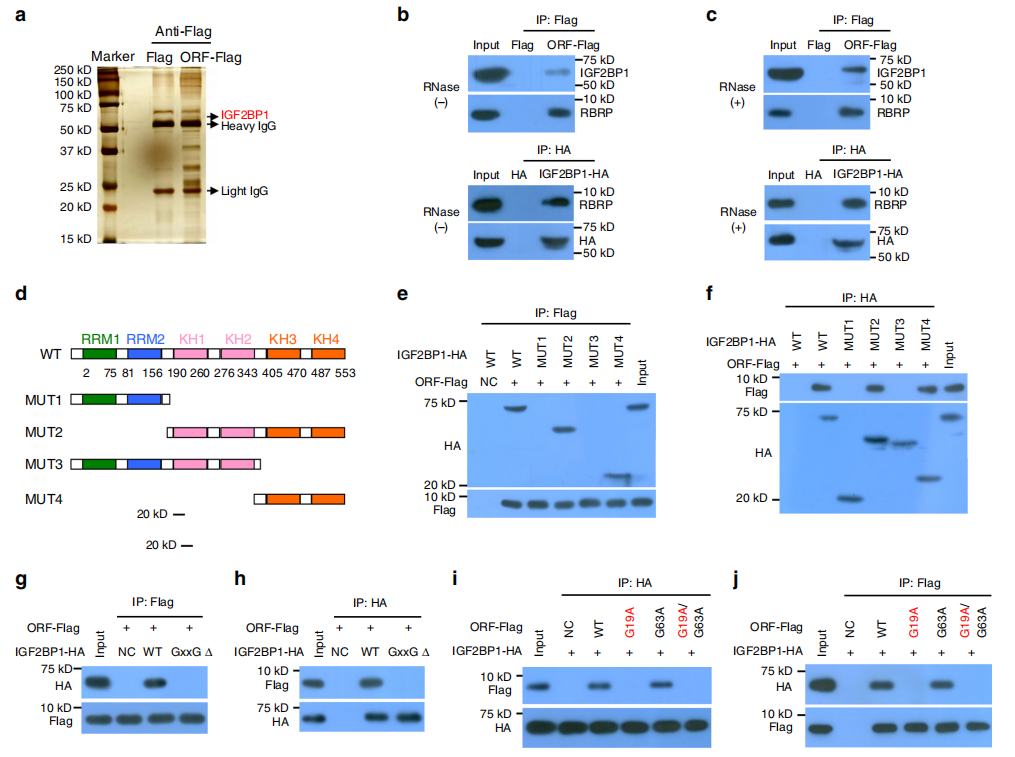
研究者进一步探究RBRP是如何影响下游靶蛋白而导致癌症的发生。利用Co-IP拉下与其相互结合的蛋白并进行质谱分析,发现目标蛋白IGF2BP1。双向Co-IP证明RBRP和IGF2BP1的相互结合关系。首先用RNaseA酶排除RNA中间体的关系,再用截断式Co-IP发现RBRP结合于IGF2BP1 KH3-4双结构域(图a-f)。先前的研究报道,KH3-4双结构域中的GxxG基序对于m6A的识别和结合是必不可少的。所以研究者在KH3-4双结构域中将GxxG突变为GEEG,可完全消除RBRP与IGF2BP1的相互作用。接下来研究了RBRP与IGF2BP1结合的结构域,结果发现G19而非A的G19 突变破坏了RBRP与IGF2BP1的结合(图i,j),这表明RBRP中的G19残基对于IGF2BP1结合是必不可少的。综合分析,RBRP 可绑定到RNA m6A阅读蛋白IGF2BP1上。
那到底是RBRP还是LINC00266-1增加了IGF2BP1对m6A的修饰?之前有研究表明IGF2BP1通过与编码区不稳定决定因子(CRD)结合稳定c-Myc mRNA,所以研究者以c-Myc CRD为检测标准,通过RNA pulldown、RIP-QPCR、Dot blot实验对比LINC00266-1 NC/ORF/MT组,验证了RBRP增加了IGF2BP1与m6A修饰的c-Myc mRNA CRD的结合(图a-c)。进一步研究发现,G19A突变体没有增加内源性IGF2BP1与m6A甲基化的c-Myc mRNA CRD的结合,这些结果表明:RBRP通过其G19残基增加IGF2BP1与m6A修饰的c-Myc mRNA CRD的结合(图d-g)。同时RIP-qPCR实验表明,当沉默m6A写入蛋白METTL14的表达,细胞内RNA m6A水平降低时,RBRP过表达诱导的内源性IGF2BP1与c-Myc mRNA CRD结合的增强显著受损,说明RBRP不会增加IGF2BP1对m6A修饰的c-Myc mRNA CRD突变体的识别(图h-i)。所以,RBRP(不是LINC00266-1本身)增强了m6A的识别和m6A阅读蛋白IGF2BP1在RNA上的结合。
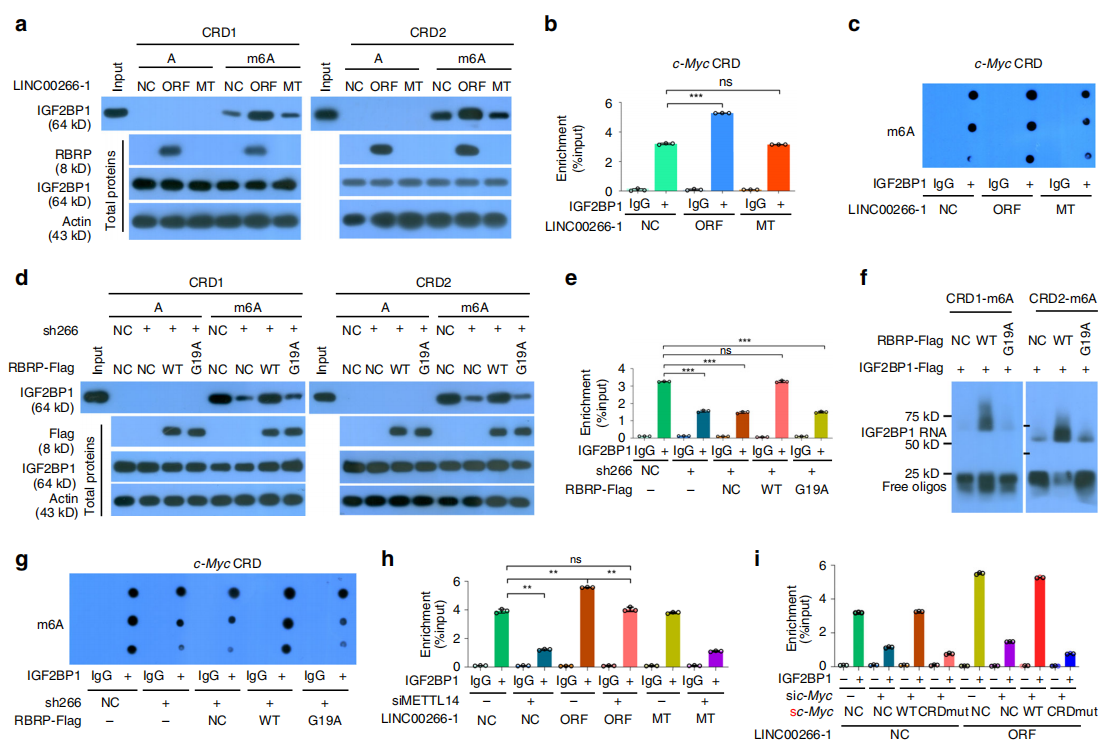
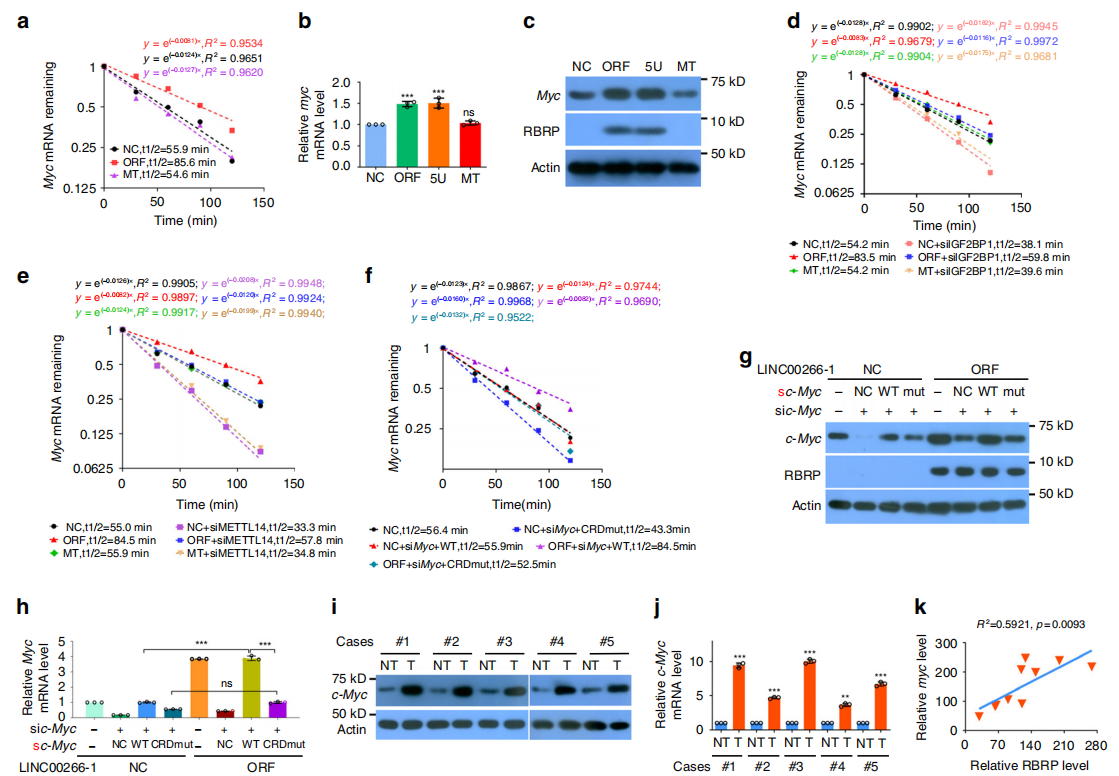
研究者接下来通过比较c-Myc mRNA的稳定性,再次排除LINC00266-1的干扰,证明是RBRP增加了c-Myc mRNA的稳定性,以及c-Myc mRNA和蛋白水平(图a-c)。IGF2BP1的干扰阻断了RBRP过表达引起的c-Myc mRNA稳定性增强(图d)。敲低METTL14后发现,RBRP过表达对c-Myc mRNA稳定性的增强作用被消除,而c-Myc mRNA CRD突变显著消除RBRP过表达引起的c-Myc mRNA稳定性增强和c-Myc mRNA和蛋白水平升高。这些结果表明RBRP以c-Myc mRNA CRD m6A依赖的方式增加c-Myc mRNA的稳定性(图e-h)。随后又通过对临床样本的检测,发现c-Myc水平与RBRP 致癌肽水平呈正相关(图i-j)。综上研究说明,RBRP通过加强IGF2BP1对c-Myc mRNA CRD的m6A识别,从而提高c-Myc mRNA的稳定性。
结果
研究者发现LncRNA LINC00266-1实际上编码了一种未标记的肽(RBRP),该肽在肿瘤发生过程中具有致癌作用。接下来发现RBRP可以与m6A阅读蛋白IGF2BP1结合使 mRNA 更加稳定。最后发现通过RBRP与IGF2BP1的结合,增强IGF2BP1对RNA的识别作用,通过增加c-Myc mRNA的稳定性和表达,从而促进肿瘤发生。



 返回列表
返回列表