 2021.01.08
2021.01.08  6162次
6162次
一、导言
今天小编分享一篇2020年11月25日发表于Cell的文章——Direct Tumor Killing and Immunotherapy through Anti-SerpinB9 Therapy(IF:38.637)癌症疗法通过引发免疫反应直接或间接杀死肿瘤,并已获得不同程度的临床应用。在这里,作者提供了一种基于直接杀伤肿瘤和触发保护性免疫来控制肿瘤生长的新疗法。丝氨酸蛋白酶抑制蛋白SerpinB9(Sb9)的基因消融导致肿瘤细胞以颗粒酶B(GrB)依赖性方式死亡。缺乏Sb9的小鼠对肿瘤表现出基于宿主免疫力T细胞的保护作用,并与肿瘤微环境(TME)中表达GrB的免疫抑制细胞减少有关。当肿瘤和宿主缺乏Sb9时,观察到针对肿瘤发展的最大保护。Sb9抑制的治疗作用通过控制肿瘤生长并延长小鼠存活时间得到证明。总之,研究者发现了一种分子靶标,该靶标可将肿瘤消融、TME干扰和免疫疗法以一种潜在的方式结合在一起,这也是该文章极具创新的核心思路。
二、结论
❶ SerpinB9保护癌细胞免受自身颗粒酶B的侵害;
❷ CAFs、MDSCs和TAMs中SerpinB9的表达促进肿瘤生长;
❸ 肿瘤和宿主中SerpinB9的缺失明显抑制肿瘤的生长;
❹ SerpinB9抑制可同时靶向癌细胞、CAFs、MDSCs和TAMs。
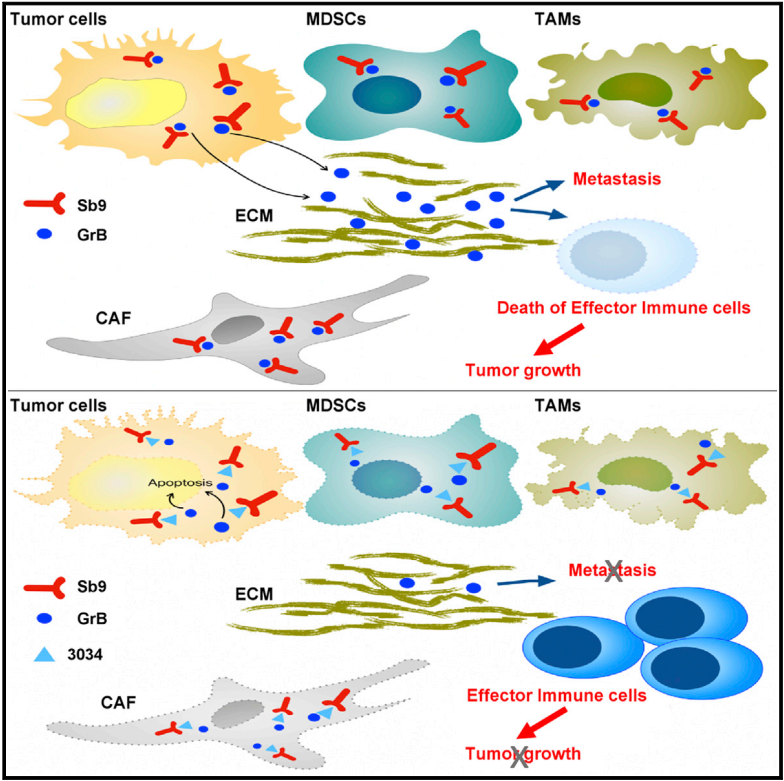
三、结果展示
# Sb9保护黑色素瘤免受GrB诱导的细胞凋亡 #
研究者检查了Sb9和GrB在原发性人类和小鼠恶性黑色素瘤(B16),乳腺腺癌(4T1)和肺腺癌(LLC1)中的表达情况(图1A、图1B)。在B16细胞中,Sb9通过经典的serpin机制抑制GrB,产生抗SDS的62 kDa Sb9-GrB复合物。WB结果表明,Sb9主要表达为47 kDa的未结合单体,而一小部分形成62 kDa Sb9-GrB复合物(图1C);几乎所有的GrB都与Sb9形成62 kDa Sb9-GrB复合物(图1D)。RNAscope染色证明B16和4T1细胞中GrB(绿色)的基因表达(图1E)。此外,GranToxiLux分析表明,B16中的GrB具有功能活性(图1F)。为了确定Sb9对GrB的保护作用,应用CRISPR/Cas9技术敲除(KO)B16细胞中的SERPINB9基因。WB验证复合物形成受阻,表明细胞中的所有GrB不再被Sb9捕获;RNAscope和IF染色也证实其在B16-Sb9 KO细胞中缺乏表达。与B16-WT细胞相比,B16-Sb9 KO细胞的GrB特异性凋亡增加2.3倍(图1H)。此外发现,在IL-2处理的B16-WT细胞中,GrB mRNA表达水平更高(图1G),细胞中裂解的caspase-3表达更低。用不同浓度的IL-2处理后,B16-WT和B16-Sb9 KO细胞的凋亡率均显著更高(图1H)。用IL-2治疗后,应用GrB抑制剂368050可抑制细胞凋亡。总的来说,这些结果表明肿瘤细胞需要Sb9来保护其免受GrB诱导的凋亡。

# Sb9的细胞内在作用调控肿瘤生长 #
将B16-WT或B16-Sb9 KO细胞皮下注射到C57BL/6小鼠中监测肿瘤生长。结果发现,植入后第27天Sb9破坏的肿瘤比B16-WT组小4倍(图2A)。此外还发现B16-Sb9&GrB KO肿瘤的生长快于 B16-Sb9 KO肿瘤,但慢于B16-WT肿瘤。植入后第17天用黑色素瘤标记物MelanA进行染色,结果显示B16-Sb9 KO组的MelanA+面积比B16-WT组小得多(图2B、图2C)。携带B16-Sb9 KO肿瘤的小鼠的中位生存时间(MST)比携带B16-WT肿瘤的小鼠的明显更长。与体内的B16-WT肿瘤相比,B16-Sb9 KO肿瘤表现出更多的凋亡情况(图2D-2F);而Tregs、TAMs(M1和M2)和MDSCs水平没有差异(图2G-2I),表明Sb9肿瘤的表达对肿瘤微环境(TME)中免疫抑制细胞群的比例影响最小。此外,B16-Sb9 KO肿瘤的转移也减少了,如肿瘤引流淋巴结(TDLNs)中黑色素瘤细胞水平的降低(图2J-2L);TDLN的大小也显著小于B16-WT组(图2K-2M)。在人黑素瘤转移灶中,可观察到Sb9和MelanA 的共表达(图2N)。C57BL/6小鼠皮下注射过表达Sb9的B16细胞后,观察到肿瘤的生长明显更快(图2P)。结果表明,Sb9的表达以细胞内在的方式促进体内肿瘤的生长和转移。
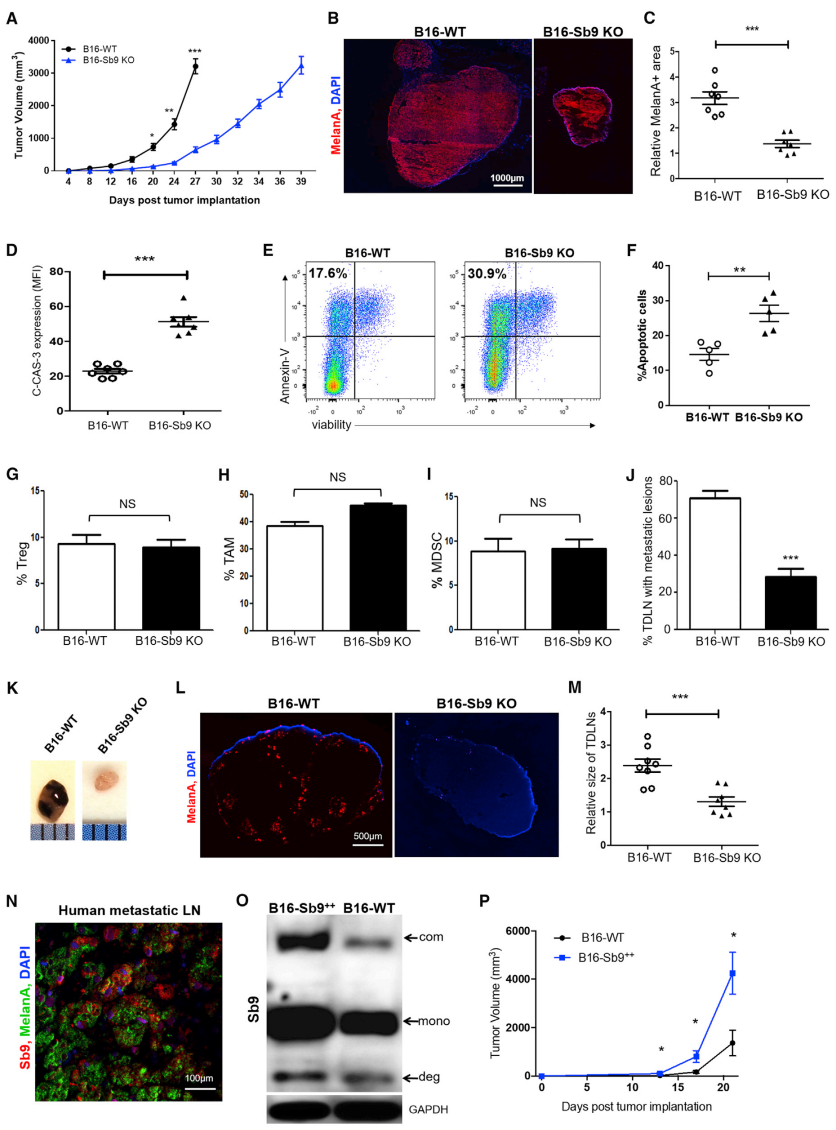
# Sb9缺失可恢复宿主肿瘤免疫并破坏TME基质 #
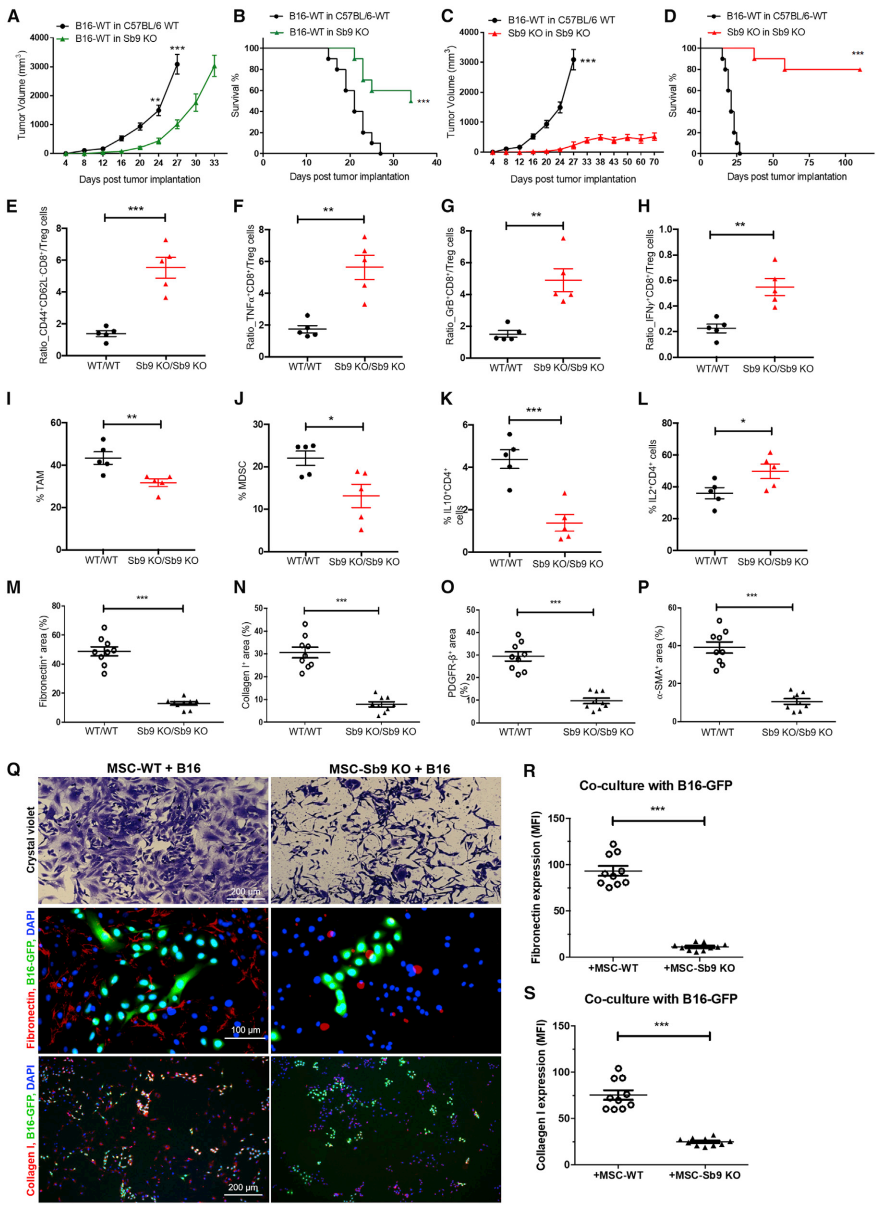
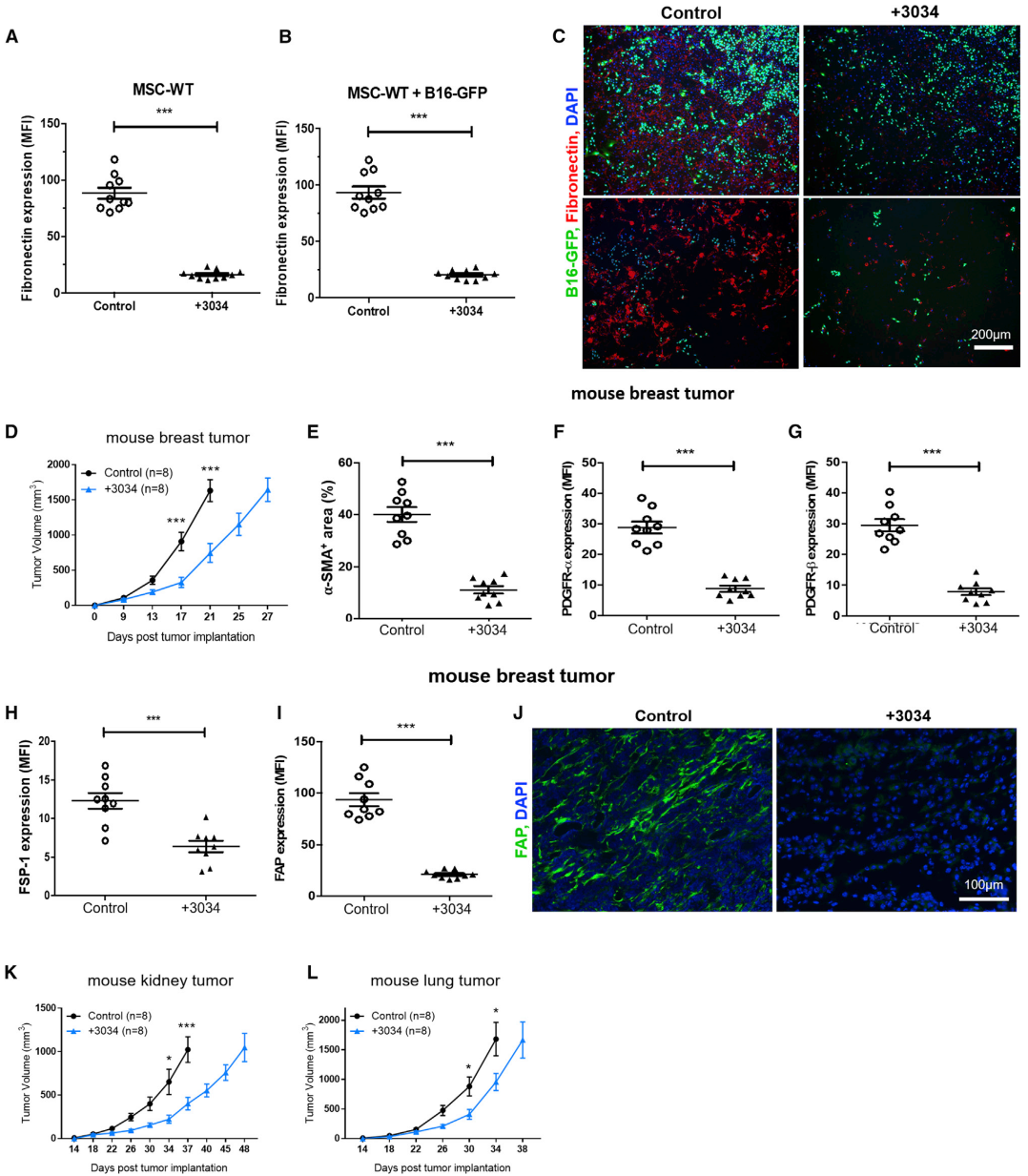
接下来研究Sb9在宿主对Sb9 KO小鼠的肿瘤免疫应答中的作用。与WT小鼠相比,Sb9 KO小鼠的黑素瘤瘤生长更慢,MST明显更长(图3A-3B)。但是,当肿瘤和宿主均缺乏Sb9时,观察到针对黑素瘤发展的最大保护作用(图3C、3D)。植入Sb9 KO肿瘤的Sb9 KO小鼠(Sb9 KO/Sb9 KO组)的MST比植入WT肿瘤的WT小鼠(WT/WT组)的长得多。与WT/WT组相比,Sb9 KO/Sb9 KO组肿瘤引起的Sb9缺乏导致caspase-3和GrB表达增加。Tregs是抗肿瘤效应T细胞的有效抑制细胞,由内源性Sb9保护其免受细胞内GrB的影响。与WT/WT组相比,Sb9 KO/Sb9 KO组的CD8+/Treg、CD44+CD62L-CD8+/Treg细胞、TNFa+CD8+/Treg、GrB+CD8+/Treg的比值均显著高于WT/WT组(图3E-3H)。除Treg外,免疫抑制性TAM和MDSC的募集在肿瘤进展中也起着至关重要的作用。结果发现,Sb9在黑色素瘤和乳腺瘤的TAM和MDSC内表达。与WT/WT组相比,Sb9 KO/Sb9 KO组的黑色素瘤切片中,TAMs和MDSCs的水平显着降低(图3I、图3J)。因此可得出结论:在Tregs、TAMs和MDSCs中,Sb9的缺失使它们暴露于TME内GrB介导的杀伤,最终导致抗肿瘤免疫应答的恢复和肿瘤发展的抑制。此外,在Sb9 KO/Sb9 KO组的TME切片中发现效应性IL-2+CD4+细胞水平升高,免疫抑制性IL-10+CD4+细胞和IL-10+CD8+细胞水平降低(图3K,图3L)。Sb9 KO/Sb9 KO组黑色素瘤中成纤维细胞(CAF)的数量,如FN、Collagen-I、PDGFR-β、α-SMA的表达显着降低(图3M-3P)。为了进一步评估肿瘤基质中Sb9表达对肿瘤生长的影响,将B16-GFP细胞与从C57BL/6-WT或Sb9 KO小鼠的骨髓中分离的间充质干细胞(MSC)共培养。共培养的MSC-WT和B16-GFP细胞的显微照片显示,MSC-WT和B16细胞组成多个密集簇,而MSC-Sb9 KO和B16细胞则分散且彼此不靠近(图3Q)。然后,评估了FN和Collagen-I的积聚(纤维化TME的替代标志物,可阻碍化疗药物渗透)。结果观察到,与B16-GFP细胞共培养时,MSC-WT比MSC-Sb9 KO细胞更容易产生FN和Collagen-I(图3Q-3S)。这些数据表明,Sb9在基质细胞中的存在促进了它们的生长、ECM纤维的合成以及对B16细胞的增殖作用。
# Sb9小分子抑制剂激活肿瘤保护性免疫 #
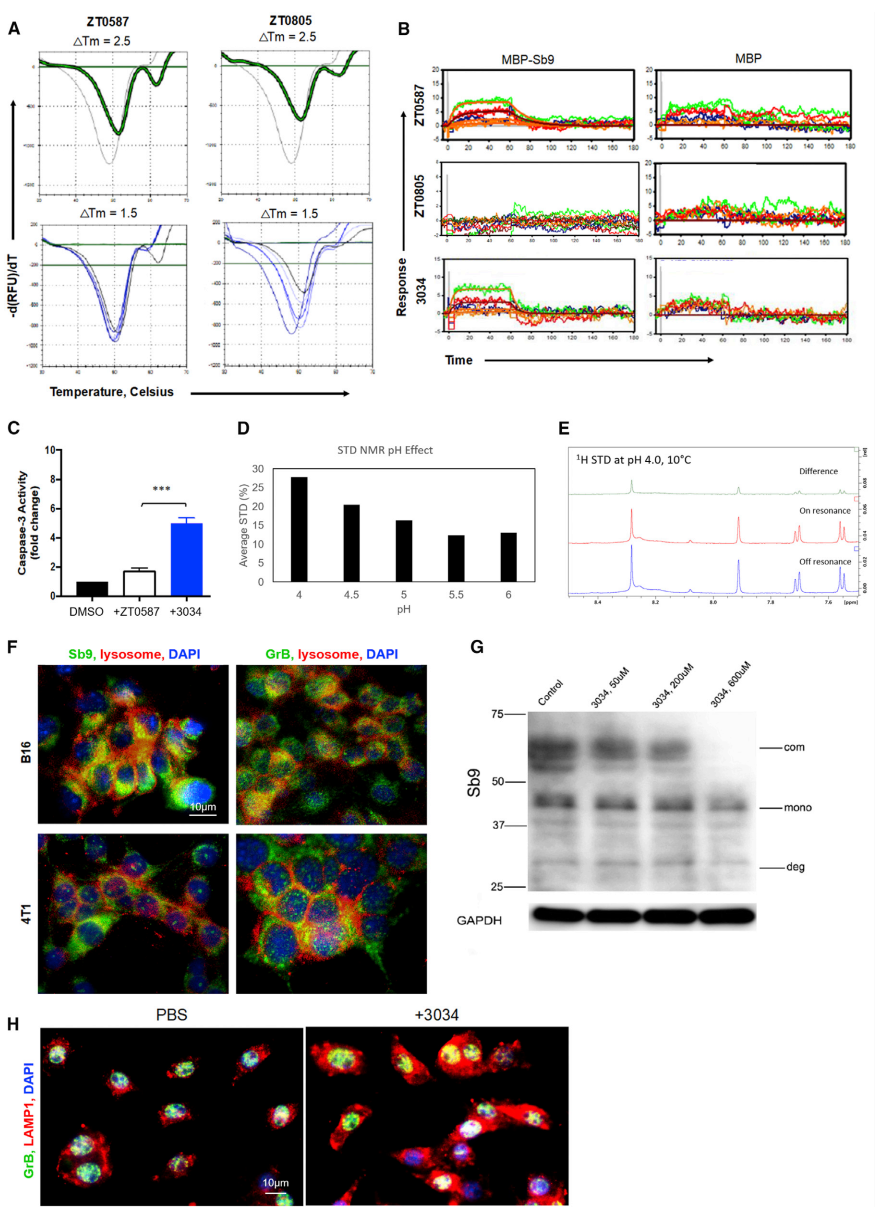
运用一种基于片段的药物发现方法来鉴定一种小的有机分子,该分子可与大肠杆菌产生的重组人Sb9结合。为表达可溶性Sb9,构建麦芽糖结合蛋白(MBP)N端融合蛋白,并用SDS-PAGE和MALDI-TOF对其进行鉴定。MBP-Sb9的功能活性通过其对分离的GrB活性的剂量依赖性抑制效应来测量。研究者开发了一种热稳定性分析方法(TSA),显示在51.5℃(Tm1)下的Sb9特异性转变,并根据剂量依赖性的Tm1偏移(图4A)用于筛选识别出两种化合物(ZT0587和ZT0805),片段ZT0587与MBP-Sb9结合,KD为88 μM(图4B)。其中一个化合物3034(1,3-苯并恶唑-6-羧酸),通过SPR测量显示出与Sb9直接结合的KD为273 μM(图4B)。接下来,通过测量caspase-3活性(GrB活性增加的替代标记物)的诱导,评估B16细胞中最高等级类似物抑制细胞内Sb9和细胞穿透的能力。与ZT0587相比,3034处理的caspase-3活性增加4倍(图4C)。此外,用3034处理的B16细胞在12 h和24 h的凋亡率均显著高于ZT0587。STD-NMR分析表明化合物3034与MBP-Sb9结合,并且以低pH依赖的方式显著增强(图4D、图4E)。当pH值低至4时,溶酶体是细胞内酸性最强的部分。因此假设溶酶体的环境有利于化合物3034与Sb9的结合。结果显示,Sb9和GrB共定位于B16细胞的溶酶体中(图4F),并且化合物3034通过B16细胞以浓度依赖性方式降低Sb9-GrB的表达(图4G)。有趣的是,化合物3034显著增加LAMP1的表达和溶酶体扩张,表明Sb9与溶酶体生物活性有关(图4H)。
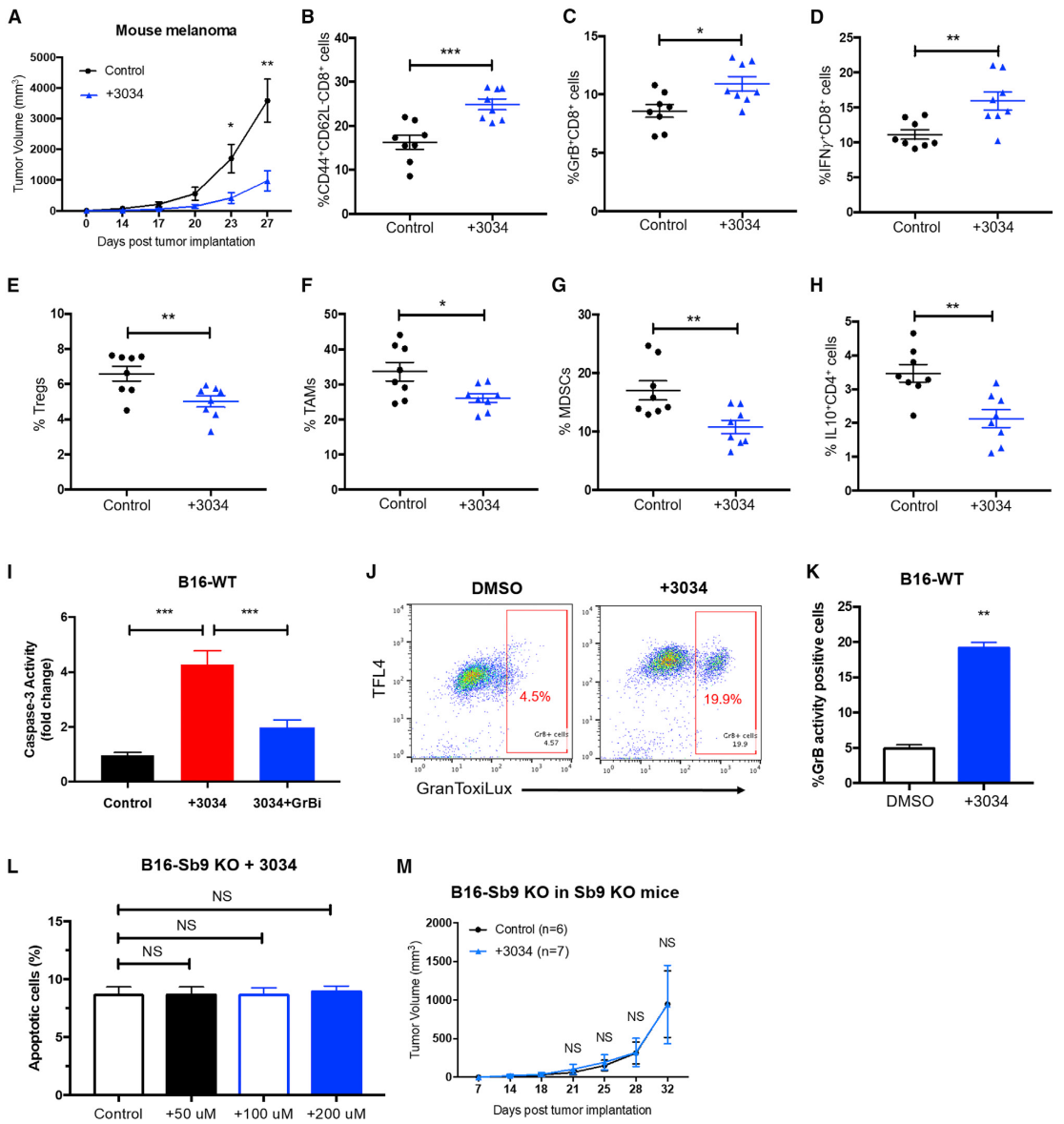
# Sb9小分子抑制剂治疗抑制体内黑色素瘤生长 #
与对照组相比,化合物3034的注射显著减少植入小鼠侧面的B16肿瘤的大小(图5A)。与对照组相比,3034治疗组的黑色素瘤切片中CD44+CD62L-CD8+细胞、GrB+CD8+细胞和IFNγ+CD8+细胞的数量均显著高于对照组(图5B-5D)。与对照组相比,3034治疗组的切片中免疫抑制性Treg、TAM 和MDSC的水平显著降低(图5E-5G)。此外,在3034治疗组的TME切片中发现IFNγ+CD4+细胞水平升高,IL-10+CD4+细胞和IL-10+CD8+细胞水平降低(图5H)。为了评估化合物3034的抗肿瘤作用是否可应用于人类疾病,研究者测试了NSG人源化A375小鼠模型的疗效。与对照组相比,化合物3034显著减少人黑色素瘤的大小。化合物3034在B16黑色素瘤中诱导GrB介导的细胞凋亡(图5I)。GranToxiLux分析证明了在用化合物3034处理的B16细胞中GrB的活性增加(图5J、图5K)。因此可得出结论:化合物3034可抑制黑色素瘤细胞中的Sb9,并使其易受GrB介导的细胞凋亡。接下来用不同浓度的化合物3034处理B16-Sb9 KO细胞,评估其对Sb9的脱靶作用,结果未观察到其他凋亡作用(图5L)。此外,与对照组相比,未观察到化合物3034对带有B16-Sb9 KO肿瘤的Sb9 KO小鼠的抗肿瘤作用(图5M)。为了进一步评估其体内毒性,将300 mg化合物3034每天两次腹腔内给药14天。CBC结果显示对照组和治疗组之间的WBC、HGB和PLT没有显著差异。血清细胞表明两组之间的AST、ALT、CRE和ALB水平相似。HE染色显示化合物3034对小鼠的肝、肾、肺和心脏组织没有毒性。
# Sb9抑制剂治疗抑制体内乳腺瘤生长 #
为了研究化合物3034对肿瘤基质的作用,将MSC-WT细胞用化合物3034处理48 h。化合物3034显著降低MSC-WT细胞产生的FN和Collagen-I(图6A),并且显著降低与B16细胞共培养的MSC-WT细胞产生的FN和Collagen-I(图6B、图6C)。乳腺癌的周围基质具有高度的免疫抑制作用。Sb9在人类原发性乳腺瘤细胞和TM内的基质细胞中高表达。因此,研究了化合物3034是否可用于治疗植入4T1乳腺瘤的小鼠。结果发现,与对照组相比,化合物3034治疗显著降低4T1衍生瘤的大小。用化合物3034治疗4T1肿瘤的MST显著长于对照组。化合物3034的处理还导致基质细胞和CAF的水平降低(图6E-6J)。此外,在另外两个体内肿瘤模型(Renca肾瘤和LLC1肺瘤)中观察到了化合物3034类似的抗肿瘤作用(图6K、图6L)。最后得出结论:化合物3034对Sb9的抑制作用在包括黑色素瘤在内的多种恶性肿瘤(乳腺癌、肺癌和肾癌)中具有抗肿瘤作用。
总结全文,实验研究表明Sb9的基因消融不仅通过CL衍生的GrB,而且通过内源性产生的GrB使肿瘤对杀伤更加敏感,共同导致了对小鼠癌症的控制。在Sb9-KO小鼠体内研究了Sb9在抗肿瘤宿主反应中的作用,发现该小鼠对肿瘤的抵抗力增强。这些是TME中免疫抑制TAMs、MDSCs、Tregs和CAFs的存活受损导致抗肿瘤CL活性增加的结果。最后研究者开发了一种Sb9特异性小分子抑制剂3034,并且显示小鼠通过对GrB的直接致敏和保护性免疫的激活来控制肿瘤的生长。


