 2021.06.15
2021.06.15  1591次
1591次
前言
本期向大家介绍一篇最近在Signal Transduction and Targeted Therapy.发表的一篇关于外泌体S100A4激活STAT3促进肝癌细胞转移的文章,文章题目为:Exosomal S100A4 derived from highly metastatic hepatocellular carcinoma cells promotes metastasis by activating STAT3。DOI:10.1038/s41392-021-00579-3,影响因子:13.493。
背景介绍
转移和复发导致约90%的癌症患者死亡,是恶性肿瘤最显着的特征。细胞间串扰在癌症进展和转移中起着重要作用。近年来研究发现,外泌体是一种有效的细胞间信号传递系统,在癌症转移中发挥关键作用,其介导的细胞间通讯被广泛认为是癌症侵袭的强大促进剂。S100钙结合蛋白A4(S100A4)是S100家族的成员,可通过调节粘附、细胞外基质重塑和细胞运动在肿瘤转移中发挥重要作用。研究者探讨了外泌体在肝细胞癌(HCC)转移中的作用以及在预后价值方面的潜在价值,发现高度转移性 HCC 细胞 (HMH) 释放的外泌体显著增强低转移性HCC细胞(LMH)的侵袭和转移,外泌体的S100A4是HCC转移的关键增强剂,其激活STAT3磷酸化和上调OPN表达,是LMH转移的新型预后标志物和治疗靶点。
研究结果
◆ HCC细胞释放和摄取的外泌体的分离鉴定
研究者从HCC细胞上清液中提取外泌体,并进行形态学观察和直径测定,发现其直径主要在 40 到 200 nm 之间(图1a)。并从6种HCC细胞系中检测到了相对特异性的外泌体标记物CD63,CD9和Alix(图1b),并发现 HMH-外泌体和 LMH-外泌体都可以被低转移性HCC 细胞、MHCC97-L 和 HepG2 有效吸收(图1c)。结果表明作者成功地分离和纯化了HCC 细胞的外泌体,并证明它们可以被其他 HCC 细胞摄取。
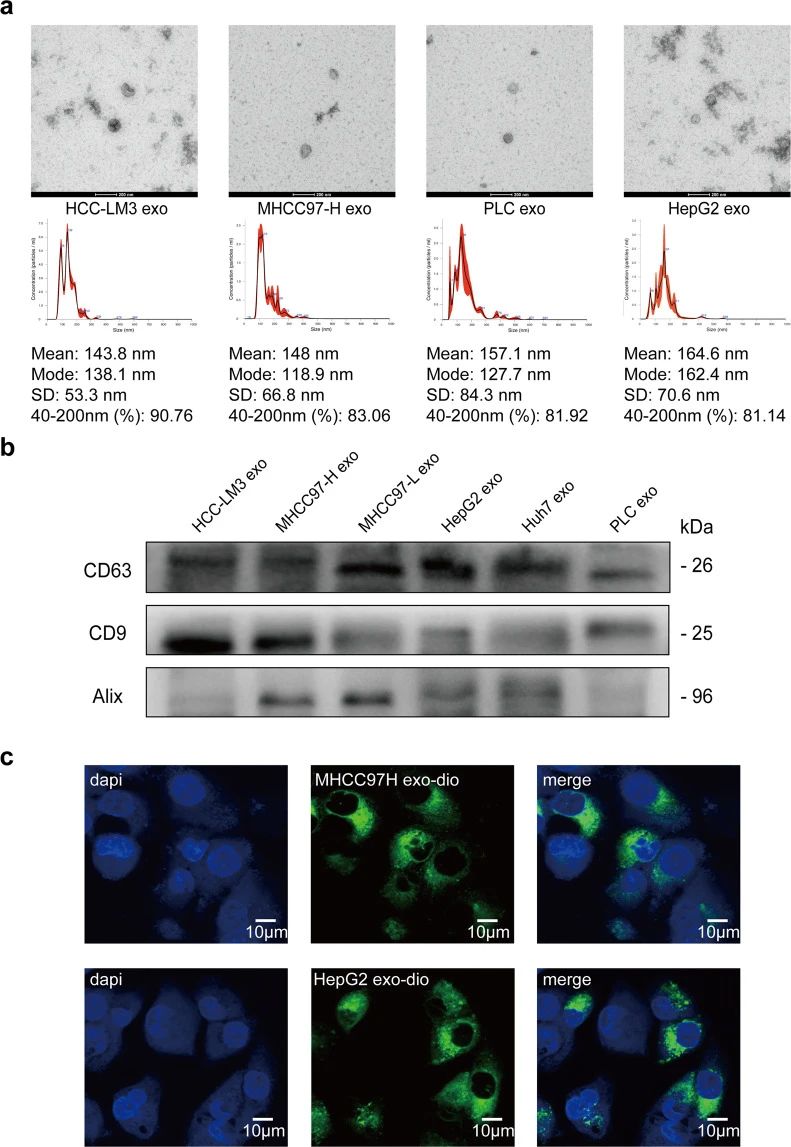
图1
◆ HMH-外泌体增强低转移性HCC细胞的转移潜能
为了研究外泌体在HCC转移的细胞间串扰中的可能作用,用HMH-外泌体处理低转移性HCC细胞,发现HMH-外泌体可提高MHCC97-L、Huh7和HepG2侵袭或迁移能力(图2a, b)。研究者用MHCC97-L细胞建立了体内原位植入异种移植模型,分别裸鼠尾静脉注射LMH-外泌体和HMH-外泌体,发现HMH-外泌体可以显着增强低转移性HCC细胞的体内生长和肺转移(图2c, d)。
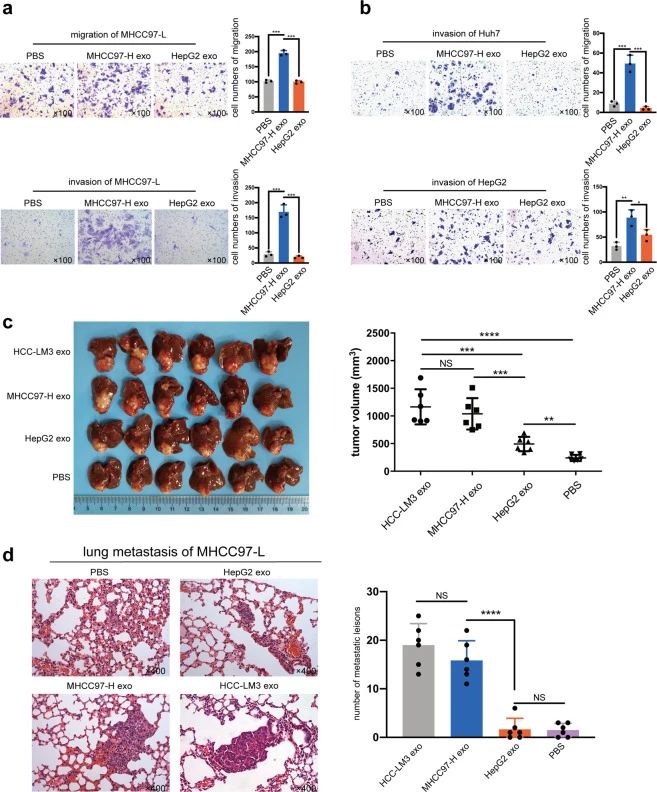
图2
◆ 外泌体的S100A4 是HCC细胞转移潜能的关键增强剂
为了确定 HMH-外泌体增强低转移性 HCC 细胞转移潜能的因素,研究者采用 iTRAQ质谱分析HMH-外泌体和LMH-外泌体,发现HMH-外泌体组有116种蛋白质显着上调,而43种蛋白质下调(图3, 4)。并进一步研究了S100钙结合蛋白家族中差异最大的四个成员:S100A4、S100A11、S100A10和 S100A6,比较了这些蛋白在5个HCC 细胞系的表达丰度,以及来自这些细胞系的外泌体中S100A4 的丰度,结果与iTRAQ数据一致(图3c)。通过敲低了HMH中的S100A4和过表达LMH的S100A4相关实验,证实富含S100A4的外泌体可增强LMH迁移和侵袭力(图3e)。同时,在裸鼠体内也发现富含S100A4外泌体提高了肺转移率(图3f)。
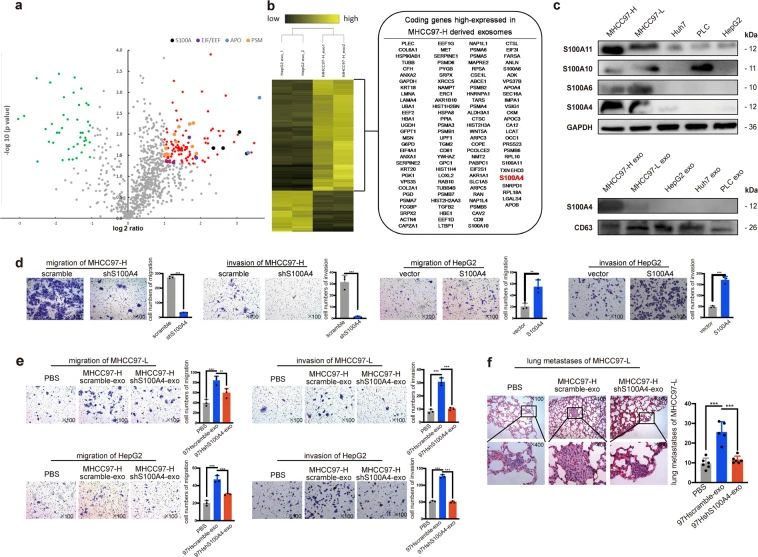
图3
◆ 外泌体的S100A4通过STAT3磷酸化激活OPN转录
为了阐明外泌体S100A4在HCC细胞转移潜能和干性方面的作用机制。研究者对癌症干性相关基因进行分析,发现OPN及其下游基因HIF1α和BMI1的表达与S100A4表达一致(图4),OPN是HCC转移和干性的关键启动子,表明外泌体S100A4有可能在HCC中参与OPN的调节。
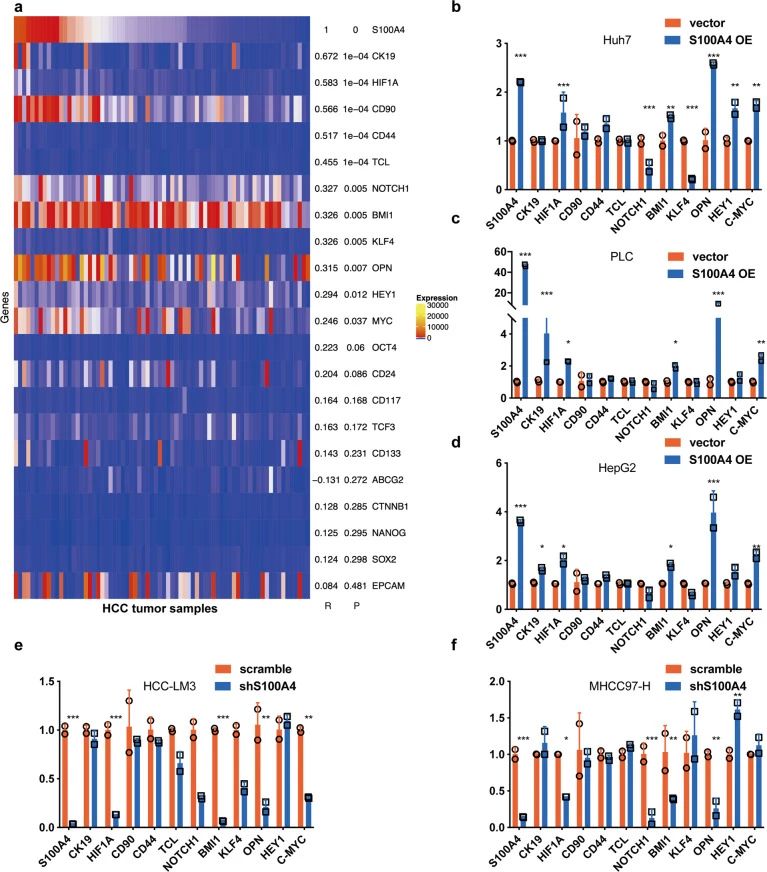
图4
研究者发现,在细胞和裸鼠体内富含S100A4 的外泌体显着促进STAT3磷酸化和 OPN表达。而且HMH的富含S100A4的外泌体促LMH的转移,且S100A4可通过激活STAT3磷酸化和上调OPN表达,促进HCC转移(图5, 6a)。
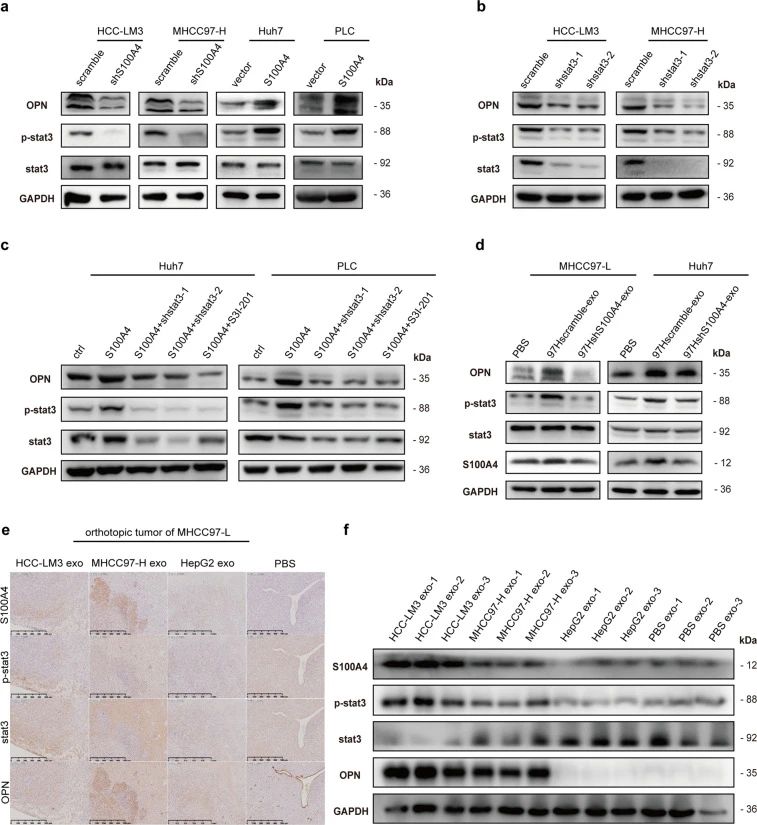
图5
血浆外泌体的S100A4 和OPN水平共同作为HCC患者术后强有力的预后因素
通过临床研究发现,HCC患者的外泌体中的S100A4比健康者高,S100A4 在转移性HCC患者中高于非转移性患者,且外泌体的S100A4和OPN水平之间存在正相关性(图6b)。通过预后模型分析,发现S100A4低、OPN水平低的HCC患者预后最好,S100A4高、OPN水平高的HCC患者生存率最差(图c-f)。
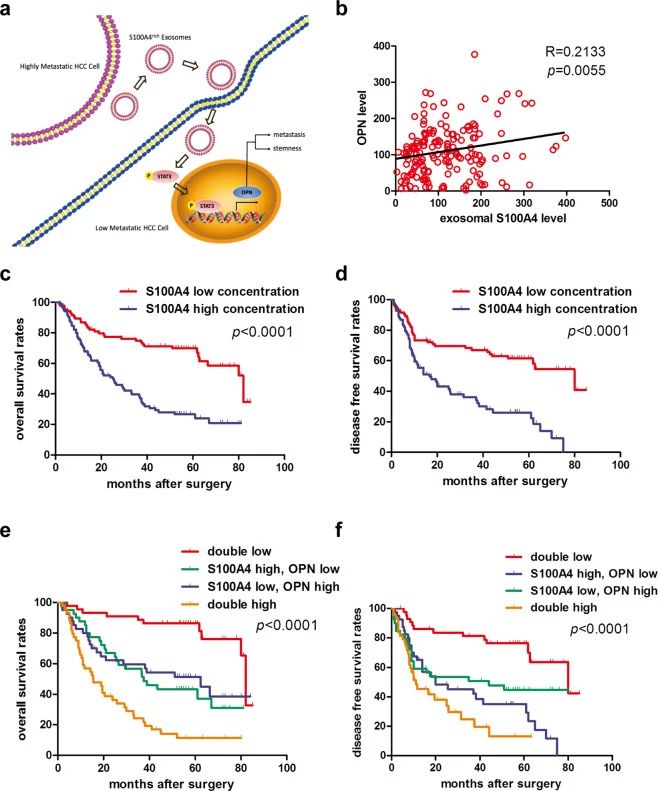
图6
总结
研究结果证明了外泌体的S100A4在调节HCC细胞干性和转移潜能方面的重要作用。高转移性HCC细胞释放的外泌体S100A4通过促进STAT3磷酸化和上调OPN增强低转移性HCC细胞的转移潜能。此外,血浆外泌体的S100A4水平结合血浆OPN水平被确定为术后HCC患者的有力预后预测因子。研究强调了外泌体的S100A4在调节HCC干性中的新功能,并提供了对S100A4参与外泌体介导的HCC通讯的见解。



 返回列表
返回列表